DNA四种碱基中的鸟嘌呤(G)碱基氧化还原性质最为活泼,OH•是生物体内反应活性最强的活性氧自由基,OH•与G碱基的反应在DNA氧化损伤等过程中扮演重要的角色。然而, OH•与G碱基的反应机理仍然存在争议:普遍接受的加成-脱水机制及最近提出的夺氢-异构化机制。解决争议的关键是区分反应过程中涉及的G自由基中间体(亚氨基dG(N1-H)•自由及氨基dG(N2-H)•自由基)并确定其反应特性。
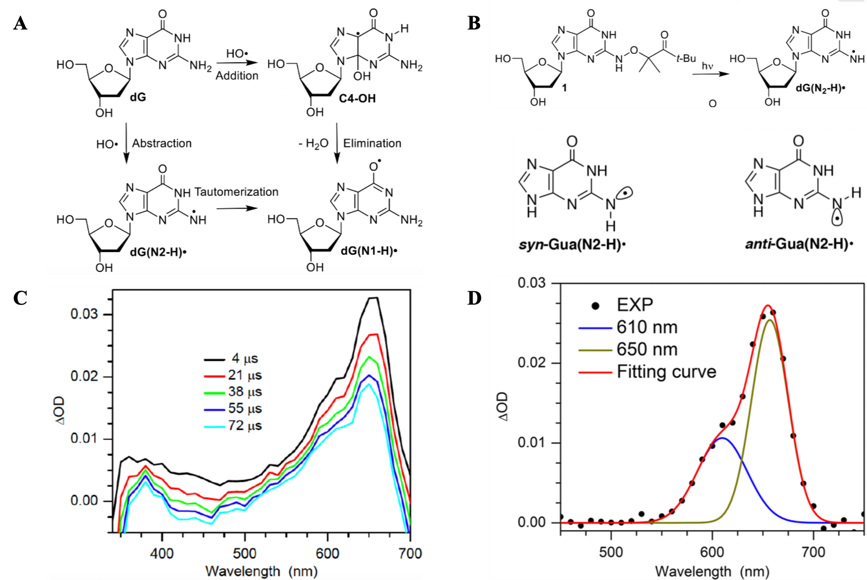
图A: OH•与G碱基反应生成dG(N1-H)•自由基的两种反应机制;图B:光诱导前体1生成dG(N2-H)•及自由基的anti-和syn-两种构像; 图C: 激光光解典型时刻的瞬态紫外-可见吸收光谱; 图D: 吸收峰分别在610 nm和650 nm的高斯线型拟合anti-和syn-构像的dG(N2-H)•瞬态吸收光谱。
最近,苏红梅老师课题组与美国约翰·霍普金斯大学Marc M. Greenberg教授课题组合作,由设计合成的核苷酸衍生物前体1和苯乙酮光敏反应制备出纯净的dG(N2-H)•自由基,通过时间分辨光谱实时探测自由基的反应过程。在瞬态紫外-可见光谱上观测到位于610 nm和650 nm的两个特征吸收峰,结合理论计算分别归属为anti-dG(N2-H)• (610 nm)和syn-dG(N2-H)• (650 nm)两种构像。同时,动力学分析表明伴随dG(N2-H)•特征吸收峰610 nm和650 nm在几百μs时间尺度上的衰减,dG(N1-H)•相对于dG(N2-H)•具有较大消光系数的370 nm处的信号却只有衰减,说明dG(N2-H)•的衰减并没有对应dG(N1-H)•的生成,排除了dG(N2-H)•在几百μs时间范围内异构化生成dG(N1-H)•的可能。研究结果为排除夺氢-异构化机制提供了关键的实验证据,并且首次在瞬态光谱上区分了dG(N2-H)•自由基的anti-和syn-两种构像,研究揭示了OH•与G碱基等DNA氧化损伤反应中的G自由基中间体的光谱特征和动力学反应机制。该研究工作得到国家自然科学基金委重点基金、杰出青年科学基金、和北京师范大学人才引进专项等项目经费的大力资助,论文近期发表在《Angewandte Chemie International Edition》(Independent Generation and Time-Resolved Detection of 2'-Deoxyguanosin-N2-yl Radical, Angew. Chem. Int. Ed. 10.1002/anie.202005300)
原文链接:https://doi.org/10.1002/anie.202005300