可同时氧化NADH和产生超氧阴离子自由基的超分子光敏剂
肿瘤乏氧是目前影响光动力治疗(PDT)疗效的一个重要原因,研究表明,I型光敏剂可以与相邻底物以及分子氧通过电子转移或质子转移生成活性氧来杀灭肿瘤细胞,相比于传统的II型光敏剂,氧气依赖性低,即使在严重乏氧条件下,仍可以有效杀灭癌细胞。但是目前报道的PDT光敏剂绝大多数为II型光敏剂,I型光敏剂鲜有报道,I型光敏剂的设计制备仍然极具挑战,并且已报道的I型光敏剂往往只关注活性氧的作用,而忽略了其他光反应过程对肿瘤的损伤。
调控激发态光敏剂的能量传递和电子转移途径是设计制备高效I型光敏剂的关键,近年来,杨清正课题组通过合理的分子设计以及超分子组装策略,分别从阻断能量传递(Angew. Chem. Int. Ed. 2021, 60, 19912–19920)和增强电子转移(Chem. Sci., 2022, 13, 5951-5956)两个方面着手制备I型光敏剂。
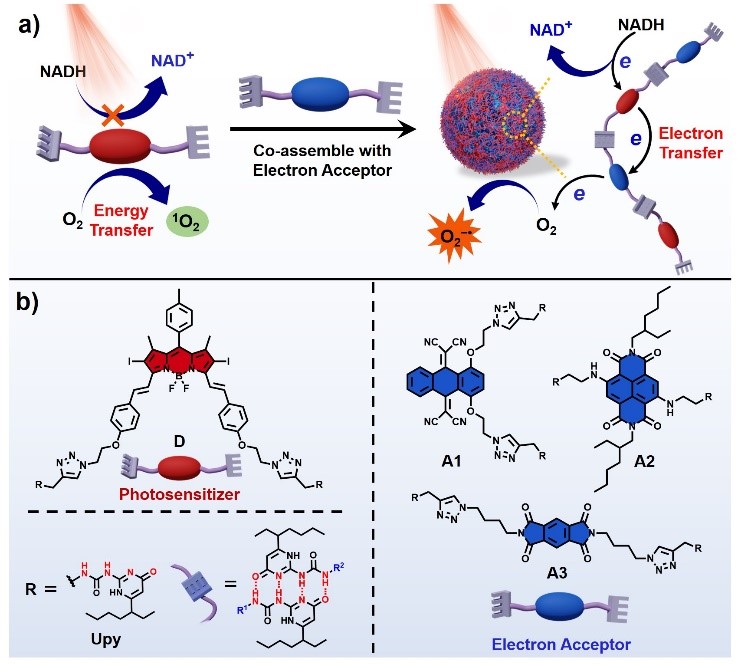
本文是在作者前期工作的基础上,提出了一种全新的I型光敏剂的制备策略,利用超分子共组装的方式在传统II型光敏剂的周围引入电子受体,促进电子转移,不仅可以有效地将传统的II型光敏剂转变为I型光敏剂,高效生成超氧阴离子自由基,而且还可以生成强氧化性的光敏剂阳离子自由基,直接氧化生物分子,加剧生物损伤,提升PDT疗效。作者设计合成了经典的基于BODIPY的II型光敏剂和三类电子受体分子,通过四重氢键作用将光敏剂与电子受体共组装形成超分子共聚物纳米光敏剂。光敏剂分子与电子受体被拉近的分子间距离以及相匹配的氧化还原电位促进了光敏剂到电子受体的光诱导电子转移,并进一步将电子转移到分子氧生成超氧自由基。此外,这一过程伴有强氧化性的光敏剂阳离子自由基的生成,其能够有效氧化活细胞中的NADH,加剧生物损伤。体内外抗肿瘤研究表明,该类超分子光敏剂即使在肿瘤细胞的缺氧环境下也表现出优异的PDT性能,在动物模型中具有明显的实体肿瘤消融效果。这是首次利用引入电子受体成功制备I型光敏剂,是对光动力治疗机制的有效补充。
北京师范大学为第一完成单位。该研究得到国家自然科学基金、化学学院的资助和支持。相关成果以题为“Supramolecular Photodynamic Agents for Simultaneous Oxidation of NADH and Generation of Superoxide Radical”发表在《Nature Communication》上。文章第一作者为北京师范大学博士后滕坤旭,通讯作者为杨清正教授。
原文连接:https://www.nature.com/articles/s41467-022-33924-3#Fig2